Retiro o corrección del mercado de productos farmacéuticos
Disposición ANMAT 1402/2008
2110-IE002 VERSIÓN 00
Generalidades
Las acciones de retiro o corrección del mercado pueden ser iniciadas por decisión de la empresa elaboradora o importadora (voluntario), o por indicación de esta Administración Nacional (ordenado).
La ANMAT, a través del Departamento de Gestión de Riesgo y Autorización de Comercialización del Instituto Nacional de Medicamentos - INAME, formalizará las acciones de retiro o corrección del mercado.
1. Inicio del trámite de retiro/corrección
Los establecimientos que deban iniciar acciones de retiro o corrección del mercado de productos farmacéuticos e IFAs deberán generar un expediente electrónico mediante la modalidad de Trámites a Distancia (TAD), bajo el trámite “Retiro del Mercado / Corrección del Mercado - Notificación de inicio y seguimiento”. A tal fin, se solicitará aportar la siguiente información:
Datos de la empresa responsable del retiro/corrección
- Razón social del establecimiento
- Nº de CUIT
- Nº de Disposición de habilitación
- Domicilio legal
- Teléfono
- Datos del director técnico (nombre completo y número de matrícula)
- Datos del responsable del retiro del mercado (nombre, teléfono y correo electrónico)
- Razón social del establecimiento elaborador (en caso de ser diferente al responsable del retiro)
- Lugar de elaboración
Datos del producto
- Nombre comercial
- Nº de certificado
- Composición cuali-cuantitativa
- Acción terapéutica
- Forma farmacéutica
- Presentación de venta (además, incluir muestras médicas)
- Condición de venta
- Cantidad de lotes involucrados
- Número de lote
- Fecha de vencimiento
- Fecha de elaboración
- Cantidad de unidades elaboradas de producto terminado aprobado
- Cantidad de unidades importadas y fecha de la importación
- Cantidad de unidades destinadas a Muestras de Retención
- Cantidad de unidades almacenadas en el depósito de la empresa (sin distribuir)
- Cantidad de unidades distribuidas
- Declaración respecto si el lote involucrado presenta muestras médicas. En caso afirmativo, detallar la cantidad de unidades elaboradas, distribuidas y en stock (sin distribuir).
- Adjuntar fotografías nítidas del envase primario, del envase secundario y del prospecto
- Declaración respecto si el producto ha sido exportado o no. En caso de haber sido exportado detallar: país receptor, número de lote, fecha de vencimiento, cantidad de unidades de cada lote y el nombre comercial con el que se exportó. Asimismo, se deberá notificar del retiro a la empresa que adquirió el producto. Luego, se tendrá que adjuntar el pertinente acuse de recibo al expediente.
En el caso de que la empresa posea más de un producto (diferente nombre comercial) dentro de un mismo motivo de retiro, deberá iniciar un expediente para cada uno de ellos.
Datos sobre el retiro/corrección
- Motivo del retiro/corrección
- Clasificación propuesta. En caso de corresponder, se deberá aportar la justificación avalada por un profesional médico
- Estrategia propuesta: establecer el alcance y el nivel de auditoría de verificación
- Listado de distribución primaria, donde conste el detalle de unidades comercializadas a cada cliente (ordenado alfabéticamente) por lote y presentación. Ver Anexo I.
Debe presentarse un listado para cada concentración y en formato excel preferentemente (para ello, utilizar la opción "Documento para conservar extensión de archivo". De esta manera, se firmará un PDF y se encontrará como archivo embebido el archivo adjunto en su extensión original).
Dependiendo del alcance, se podrá solicitar el listado de distribución secundaria. - Cantidad total de clientes primarios
- Modelo de nota enviada por la empresa responsable del retiro/corrección a sus clientes primarios comunicando el motivo y solicitando la devolución de las unidades.
En la referida notificación se deberá solicitar al cliente que aporte la siguiente información: nombre o razón social del establecimiento, descripción del producto implicado (nombre comercial, presentación, lote y vencimiento), cantidad de unidades existentes en stock por lote (incluir si NO poseen unidades en stock para devolver), fecha, firma y sello del director técnico actuante.
Asimismo, en caso de que el alcance establecido sea a nivel de distribución secundaria, es de suma importancia que en dicho comunicado se aclare al respectivo cliente primario que tendrá la obligatoriedad de informar de manera periódica (según plazo establecido por el laboratorio) los resultados obtenidos de la recolección de unidades por parte de los clientes a los que se les comercializó el producto en cuestión; a fin de actualizar el dato sobre el número de unidades que ingresen a su stock.
Además, se tendrá que requerir la información respecto a la cantidad total de clientes secundarios que intervienen en la cadena de comercialización.
2. Seguimiento de retiro/corrección
Mediante TAD, a través de la opción “Presentación ciudadana/Presentación a agregar”, se deberá presentar la siguiente documentación e informes periódicos sobre el avance de recuperación de unidades:
- Notificaciones enviadas a los clientes primarios (por correo electrónico preferentemente), solicitando información acerca de la cantidad de unidades almacenadas en depósito y la devolución de dichas unidades
- Constancias de las respuestas recibidas de los clientes involucrados en la cadena de comercialización sobre la declaración de unidades en stock.
En este sentido, se solicitará inicialmente las respuestas remitidas por los clientes primarios y de ser necesario se requerirán las contestaciones de los clientes secundarios.
- Porcentaje de respuesta obtenida por parte de los clientes primarios
- Cantidad total de clientes secundarios y porcentaje de respuesta obtenida por parte de los mismos, según el alcance establecido
- Cantidad de unidades recuperadas, por lote y presentación, incluyendo las muestras médicas
- Planilla con los datos del avance del seguimiento. Ver Anexo II.
Nota aclaratoria
A medida que la empresa recopile notificaciones de los clientes e información respecto a la cantidad de unidades recuperadas tendrá que actualizar la documentación del expediente, debiendo modificar la información detallada en las planillas oportunamente presentadas.
3. Finalización del retiro/corrección
Según lo establecido en la Disposición ANMAT N° 1402/08, la Autoridad Sanitaria determinará la destrucción del lote o partida, no pudiendo la empresa proceder a la destrucción de las unidades recuperadas sin la previa autorización por escrito de la misma.
La ANMAT, a través del Departamento de Gestión de Riesgo y Autorización de Comercialización, dará por finalizado el retiro/corrección de un producto luego de haber evaluado todas las medidas y esfuerzos implementados por la empresa para la remoción definitiva o corrección del producto involucrado.
En cada caso, el establecimiento deberá adjuntar al expediente electrónico iniciado la siguiente documentación:
Corrección del Mercado:
- Solicitud de autorización de reingreso al mercado de las unidades corregidas
- Informe de análisis que asegure que el producto se encuentra en condiciones de reingresar al mercado. En este sentido, la empresa tendrá que comunicar el número del nuevo lote asignado, según lo establecido en el ítem 5.73 de la Disposición N° 3827/18.
- Cantidad total de unidades corregidas
De no existir objeciones, se autorizará el reingreso de las unidades corregidas al mercado y la corrección podrá considerarse finalizada.
Retiro del Mercado:
- Solicitud de autorización de destrucción de las unidades recuperadas
- Cantidad total de unidades a destruir con el detalle de número de lote y presentación, incluyendo las muestras médicas
De ser concedida la autorización, se deberá notificar al Departamento de Gestión de Riesgo y Autorización de Comercialización el lugar, la fecha y la hora del proceso de destrucción; con un plazo de antelación de al menos 48 horas hábiles. Dicha operatoria deberá llevarse a cabo ante Escribano Público, quien tendrá que labrar un acta notarial dando fe de la identidad y cantidad de unidades a destruir. Una vez finalizado el procedimiento de destrucción, se deberá adjuntar al expediente electrónico el acta notarial y el certificado de destrucción correspondiente.
De no existir objeciones, el retiro del mercado podrá considerarse finalizado y se comunicará a la empresa tal situación.
Nota aclaratoria
En el caso de tratarse de un retiro de productos psicotrópicos/estupefacientes, la firma deberá seguir los lineamientos de destrucción establecidos por la Dirección de Vigilancia de Sustancias Sujetas a Control Especial.
Departamento de Gestión de Riesgo y Autorización de Comercialización
Jefa de Departamento Bioq. Farm. María Alejandra Drucaroff
Dirección de Fiscalización y Gestión de Riesgo. INAME - ANMAT
Contacto: [email protected]
Nota aclaratoria
El referido correo electrónico es de uso exclusivo para consultas o cuestiones relacionadas a la tramitación o procedimiento del retiro/corrección del mercado de un producto, y no para el envío de documentación que deba ser adjuntada al expediente electrónico.
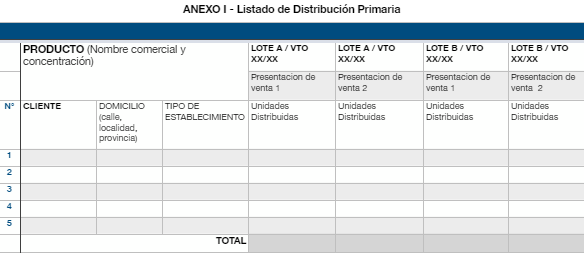
1- Confeccionar una planilla para cada concentración del producto.
2- El detalle de los clientes deberá realizarse por orden alfabético. No podrá figurar dos veces el mismo cliente, a excepción de las empresas que cuenten con varias sucursales. En tal caso, se tendrá que consignar cada una de las filiales como un cliente diferente.
3- Unidades distribuidas: cantidad de unidades de producto terminado distribuidas por el laboratorio responsable del retiro/corrección o por la empresa de distribución contratada.
4- El archivo que se adjunte al expediente deberá presentar un formato excel preferentemente. Para ello, utilizar la opción "Documento para conservar extensión de archivo", de manera de mantener su extensión original en TAD. En caso de tratarse de un archivo en formato PDF, la planilla que se anexe no deberá superar el ancho de la hoja, a fin de evitar disociación de la información.

1- Confeccionar una planilla para cada concentración del producto.
2- El detalle de los clientes deberá realizarse por orden alfabético. No podrá figurar dos veces el mismo cliente, a excepción de las empresas que cuenten con varias sucursales. En tal caso, se tendrá que consignar cada una de las filiales como un cliente diferente.
3- Unidades distribuidas: cantidad de unidades de producto terminado aprobado distribuidas por el laboratorio responsable del retiro/corrección o por la empresa de distribución contratada. En el caso de tratarse de varios lotes, la información solicitada en las tres columnas deberá quedar agrupada por lote y presentación.
4- Unidades en stock: cantidad de unidades almacenadas en el depósito de un establecimiento (en este caso del cliente primario).
5- Unidades totales notificadas por el cliente primario: es la sumatoria de la totalidad de unidades en stock que fueron informadas en cada notificación remitida por el cliente primario (unidades remanentes sin distribuir más las unidades que fueron recuperadas del mercado)
Luego de la primera notificación remitida por el cliente primario respecto a las unidades remanentes que posee en su stock (SIN DISTRIBUIR) al momento de recibir el comunicado por parte de la firma encargada del retiro, cada empresa deberá establecer un tiempo prudencial para que el cliente primario recupere parte de lo distribuido a sus respectivos clientes (teniendo en cuenta que el número de unidades en stock del cliente primario se incrementará a medida que recolecta unidades del mercado). Cumplido el plazo establecido por el laboratorio, el cliente primario tiene que notificar el TOTAL de unidades que recuperó del mercado e ingresó a su stock. De esta manera, se evitarán las constantes respuestas por parte de los clientes primarios cada vez que reciban unidades de sus clientes. Tal información tendrá que acompañarse de la respectiva notificación remitida por el cliente primario.
Cabe aclarar que a medida que la empresa responsable del retiro reciba nuevas notificaciones por parte de sus clientes, deberá actualizar el valor acumulado en una nueva planilla del presente anexo.
Con respecto a las presentaciones hospitalarias, se informa que en el caso de que el cliente posea la presentación de venta incompleta deberá notificar el número de unidades completas del producto en su envase primario. 6- Unidades recuperadas: cantidad de unidades de producto terminado aprobado recuperadas por la empresa responsable del retiro/corrección, que se encuentran almacenadas en su depósito o en el de un tercero contratado.
7- El archivo que se adjunte al expediente deberá presentar un formato excel preferentemente. Para ello, utilizar la opción "Documento para conservar extensión de archivo", de manera de mantener su extensión original en TAD. En caso de tratarse de un archivo en formato PDF, la planilla que se anexe no deberá superar el ancho de la hoja, a fin de evitar disociación de la información.
Descargas
Anexo I Retiro o corrección del mercado de productos farmacéuticos (xlsx) (78.6 Kb)
Descargar archivoAnexo II Retiro o corrección del mercado de productos farmacéuticos (xlsx) (87.8 Kb)
Descargar archivo